走査型X線顕微鏡の観察結果
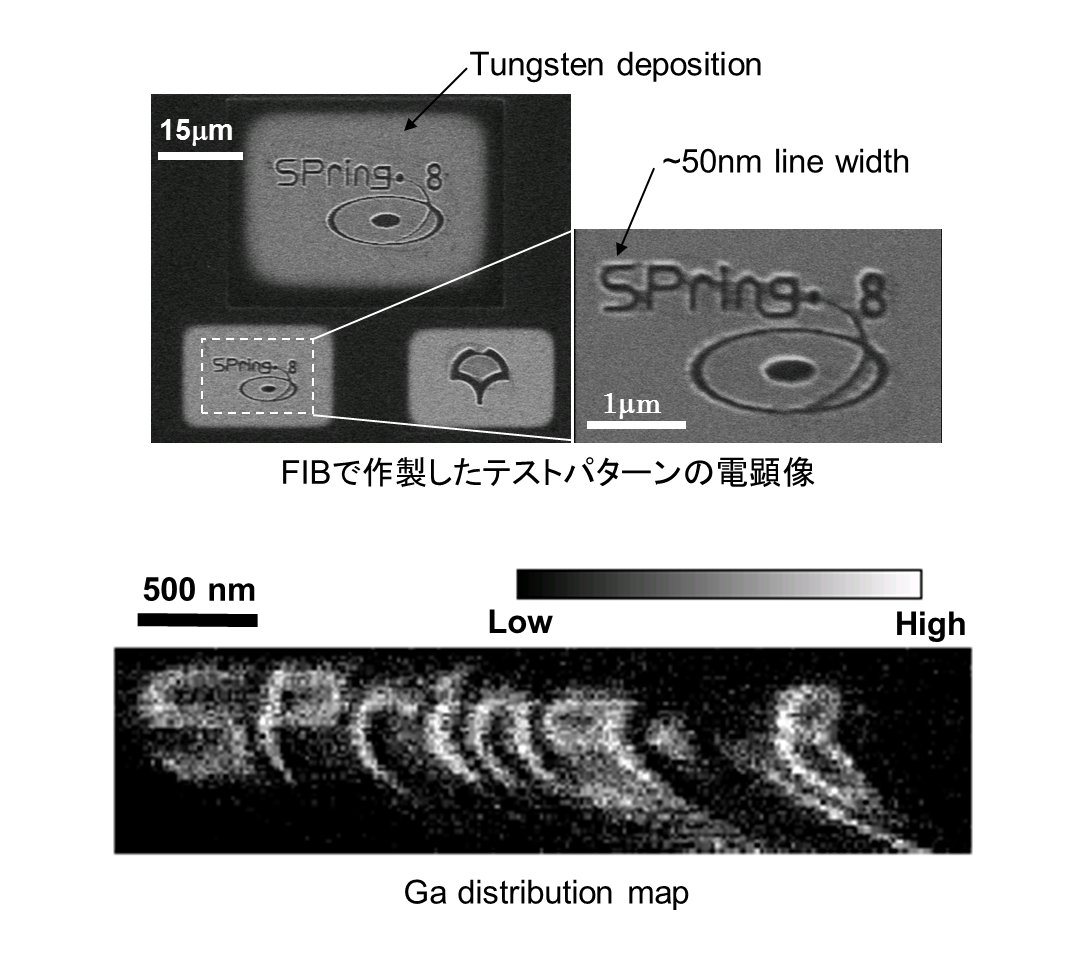
①テストパターンの高分解能元素分布観察(2006年ごろ)【発表論文】
テストパターンは,SiN膜(200nm厚)の上にタングステンを堆積させ,ガリウムイオンを使ったFIBを用いて書いた.これを30×50nmの集光X線ビーム(エネルギー:15keV)を用いて観察した.削られたタングステンと埋め込まれたガリウムの元素分布を約30nmの分解能で可視化することに成功した.
②テストパターンの定量的な元素分布観察(2007年ごろ)【発表論文】
①と同じテストパターンの元素分布観察を行った.白金とニッケルで作った標準試料を前もって測定することで,元素分布を半定量した.用いた集光ビームは100×100nmである.検出下限として,0.009fg(ガリウム)と0.012fg(タングステン)が得られた.下図のスケールバーの数字は元素の重さ(fg)を意味する.

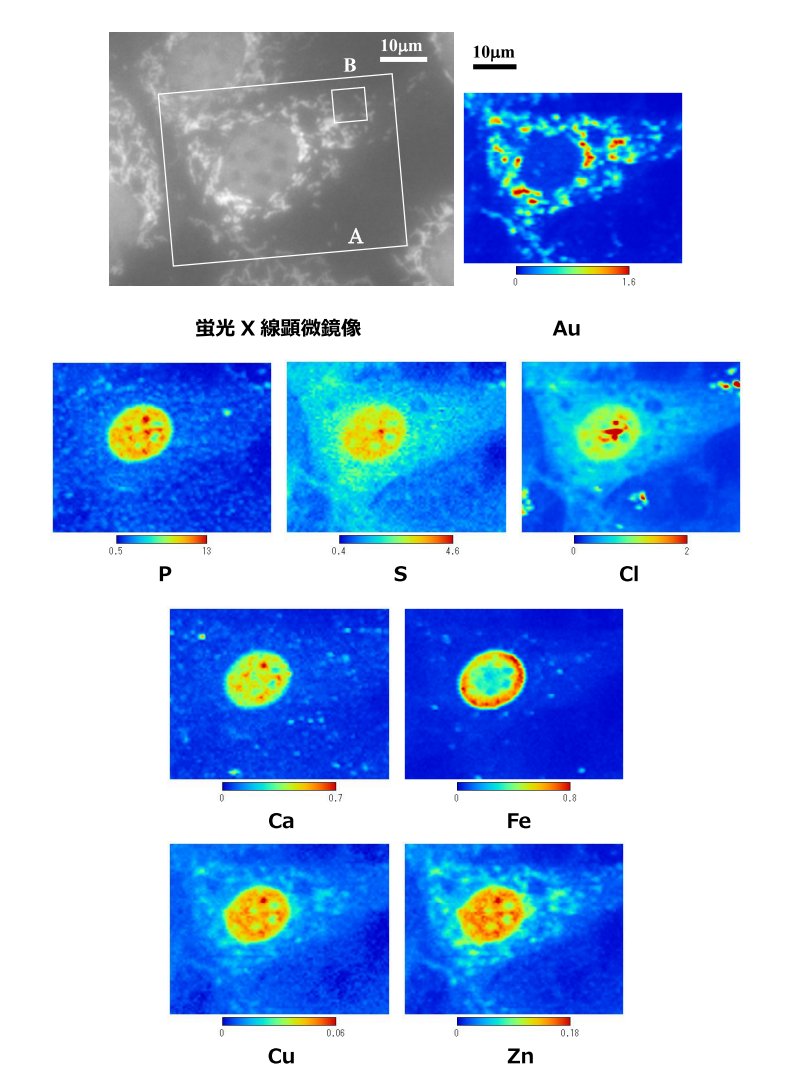
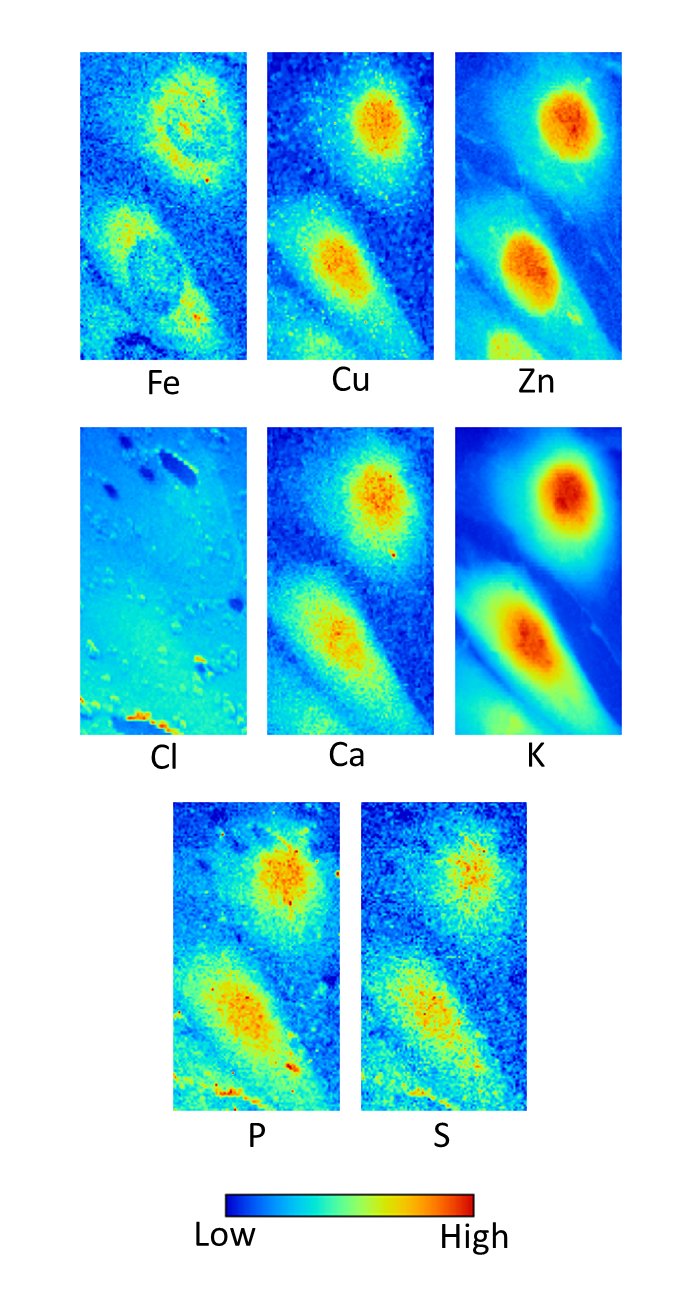
③細胞内元素分布の観察(2008年ごろ)【発表論文】
NIH/3T3細胞を高分子フィルム上に培養した.パラホルムアルデヒドで化学固定し,ミトコンドリア(ATP synthase β)に免疫染色で金コロイドをラベルした.これを乾燥させることで,X線顕微鏡用の試料とした.15keVの集光X線を使って測定した(下図).カラーバーはビーム照射領域に存在する元素含有量(fg)を意味する.
化学固定しているため,イオンは流れ出ていると思われるが,タンパク質に強く結合した元素を高感度・高分解能にて可視化することに成功した.
さらに,高分解能でBの領域を観察した結果が下図である.
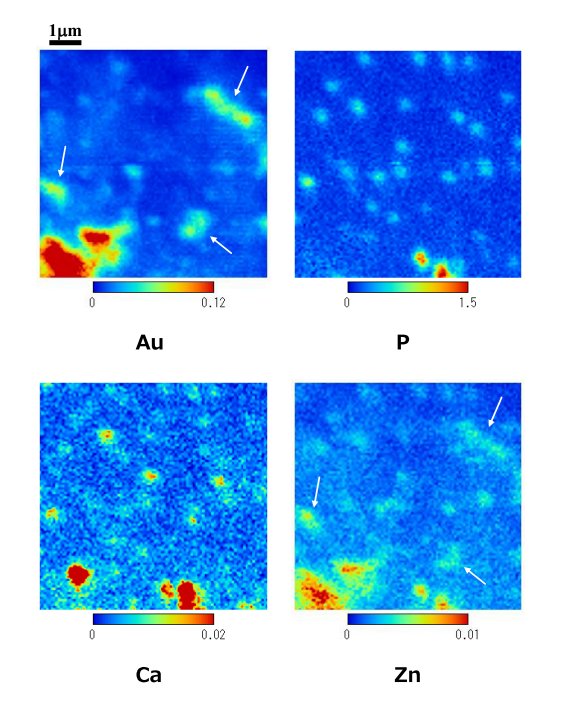
矢印はミトコンドリアが存在する箇所を示している.
④急速凍結された細胞内元素分布の観察(2009年ごろ)【発表論文】
NIH/3T3細胞をSiNメンブレン上に培養し,これを特別なバッファで洗浄した後,急速凍結した.極低温を維持したまま,15keVの集光X線を使って測定した.
急速凍結しているため,細胞内のすべての元素を可視化することに成功した.この結果は,化学固定された細胞内元素と少し異なっている.特に,イオンが主であるカリウムやタンパク質に弱く結合していると思われる鉄は大きく異なる傾向があった.一方で亜鉛や銅のようにタンパク質に強く結合している元素ではほとんど変化がないという傾向が得られた.
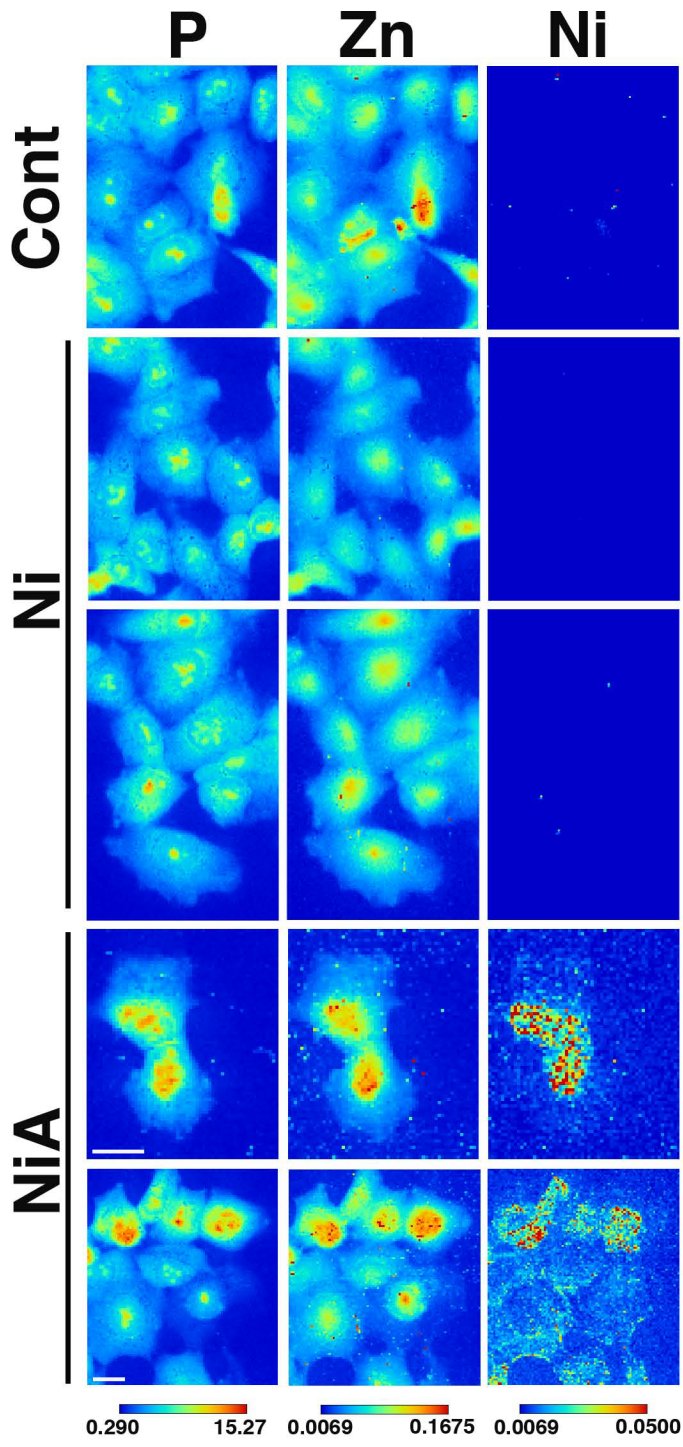
⑤ニッケル含有ペプチドが投与された細胞の元素分布観察(2015年ごろ)【発表論文】
HT1080細胞を高分子フィルム上に培養し,新規合成したbranchedペプチドにニッケルイオンを結合(ニッケルイオンと選択的に錯体を作る)させたものを投与した.
ニッケルイオンを細胞核内に輸送できたことを元素分布で直接証明した.下図は,リン,亜鉛,ニッケルの細胞内元素分布.左側ラベルの”Ni”は,ニッケルをイオンの状態で投与した.一方で,”NiA”はペプチドにニッケルイオンを結合させた状態で投与した.NiAの時のみ細胞内にニッケルが輸送できた.また,一部の細胞には,細胞核内にニッケルを輸送することができた.
スケールバーは10um.カラーバーはfg/um^2.
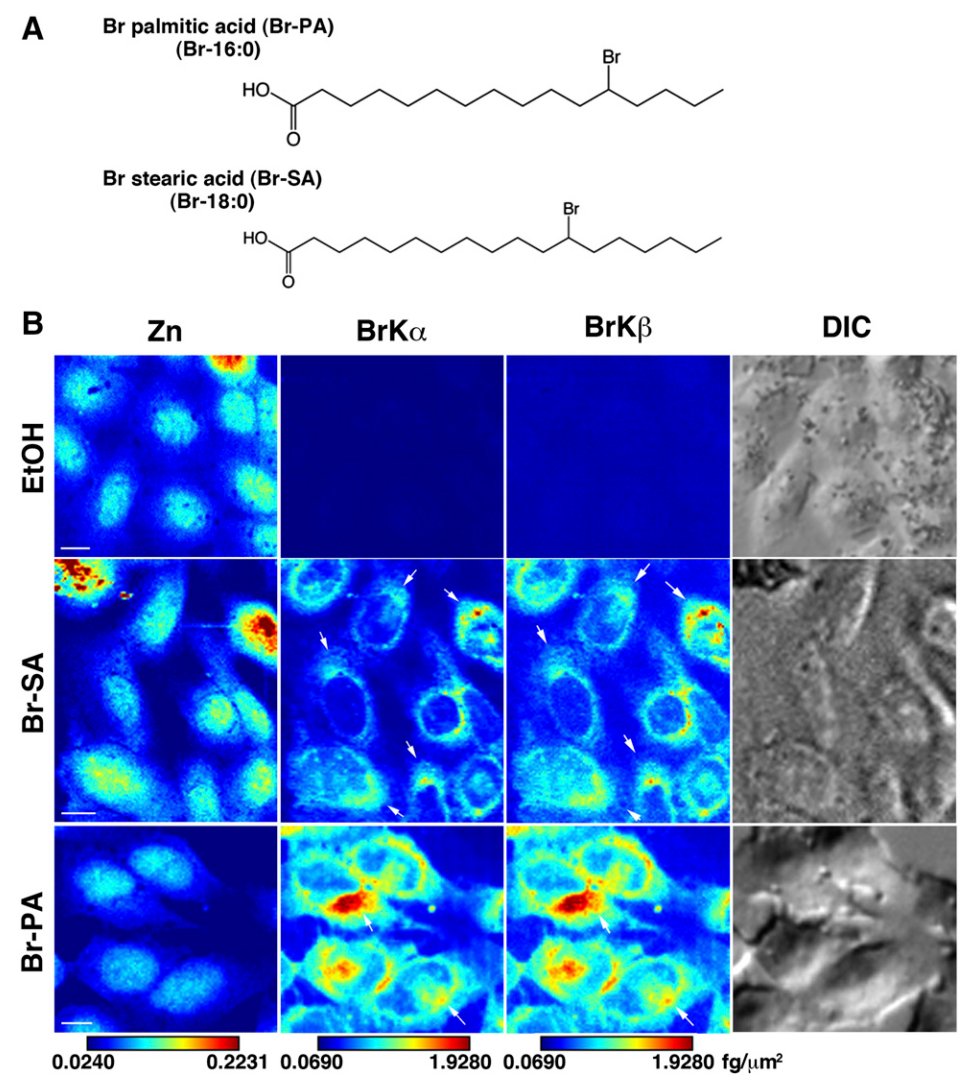
⑥Brラベル脂肪酸が投与された細胞の元素分布観察(2016年ごろ)【発表論文】【プレスリリース】
脂肪酸は低分子のため,蛍光ラベルすることが難しく,細胞内の分布を可視化することは不可能とされてきた.一原子である臭素(Br)でラベルされた脂肪酸を開発し,これをSXFMで可視化することで,脂肪酸の細胞内分布を可視化することに成功した.
マウス由来のCHO-K1細胞をSiNメンブレン上に培養し,新規合成したBrラベル脂肪酸(パルミチン酸,ステアリン酸など)を取り込ませた.SXFMによってBr分布が確認できたことから,脂肪酸は意図した通り細胞に取り込まれたことがわかった.生化学的な検討から,この脂肪酸は概ねリン脂質に代謝されていることが明らかになった.下図は,臭素の細胞内元素分布(Bar: 2μm)であり,これは細胞内のリン脂質の分布であると考えられる.Brラベル脂肪酸を添加していない細胞からはBrは検出されなかった.